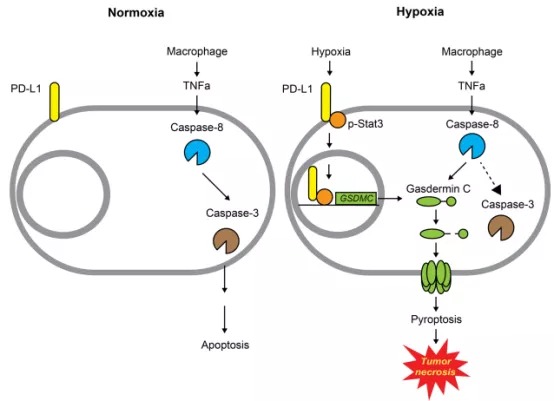
2020年9月14日,来自美国德克萨斯大学安德森癌症中心的Mien-Chie Hung(洪明奇)教授在Nature子刊Nature Cell Biology(影响因子为20.042分)杂志上发表题为“PD-L1-mediated gasdermin C expression switches apoptosis to pyroptosis in cancer cells and facilitates tumour necrosis”的研究性论文。在这篇论文中,作者发现在肿瘤细胞中,PD-L1能够促进gasdermin C的表达,从而促进细胞焦亡和肿瘤发生。

在介绍论文之前,不得不介绍一下本文的通讯作者Mien-Chie Hung教授。他是美国安德森癌症中心终身教授、分子与细胞肿瘤学系主任,现任中国医药大学校长(中国台湾)。作为肿瘤学领域的顶尖科学家,Mien-Chie Hung教授过去三十年来总共发表了670余篇论文,总被引次数高达50000多次,学术H指数高达122,并且他还是知名期刊Cancer Cell的发起人之一。由于学术上的突出贡献, Mien-Chie Hung教授于2002年当选为台湾中央研究院院士、2010年被选为美国科学促进会的会员。
然而,这样一位优秀的科学家近两年却被曝多篇论文涉嫌学术不端,其中有两篇论文已经被撤稿,还有20篇论文在调查之中。
虽然还有一些论文还在争议之中,但是Mien-Chie Hung教授却始终没有停住科研的脚步。自今年以来,他已经发表了20多篇论文,其中包括1篇主刊和5篇子刊,今天我们一起来看看他最新发表在Nature子刊上的这篇论文。
研究背景
2018年10月1日,诺贝尔生理学或医学奖授予美国免疫学家詹姆斯·艾利森(James Allison)和日本生物学家本庶佑(Tasuku Honjo),以表彰两位科学家在肿瘤免疫学的贡献。其中Tasuku Honjo最主要的贡献在于发现了T细胞抑制受体PD-1,后者通过与配体PD-L1结合抑制T细胞功能,从而促进肿瘤发生。PD-1和PD-L1是肿瘤治疗的重要免疫检查点,对于机体的抗肿瘤免疫至关重要。除了在肿瘤治疗中起到免疫检查点作用,PD-L1是否还存在其他功能目前还知之甚少。
研究内容
1. 为了探究PD-L1的新功能,作者使用多种方式处理肿瘤细胞,包括细胞压力,自噬,细胞因子,药物和PD-L1抗体。结果显示在低氧压力下,PD-L1出现了明显的核转移,并且这种核转移不依赖于HIF1α。
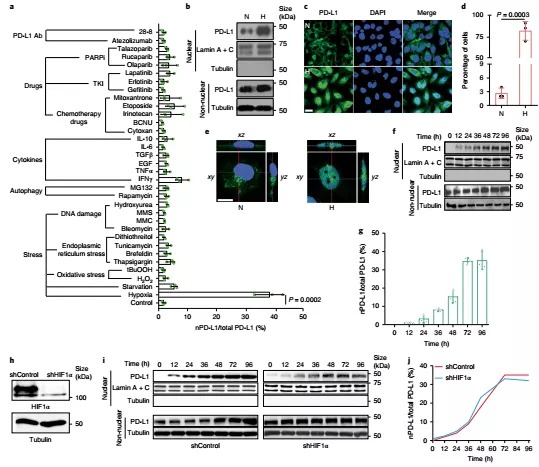
2. 在低氧条件下,PD-L1究竟如何进入细胞核中呢?先前有研究指出低氧能够诱导转录因子Stat3-Y705磷酸化入核,因此作者猜想PD-L1入核可能和Stat3-Y705磷酸化相关。通过免疫共沉淀和免疫荧光实验,作者发现Y705位点磷酸化的Stat3通过与PD-L1的细胞内结构域相互作用促进后者入核。
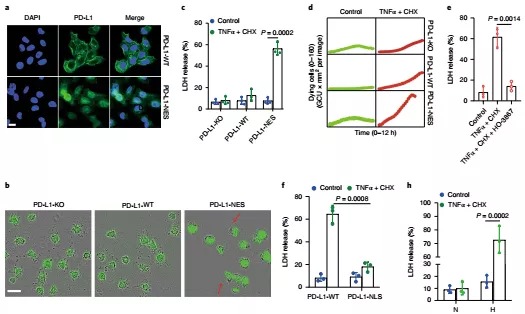
3. 接下来作者探究这种定位于细胞核中的PD-L1(nPD-L1)的功能。通过突变PD-L1的核输出信号(PD-L1-NES),作者在肿瘤细胞中稳定表达nPD-L1。令人意外的是当使用TNF处理细胞后,细胞呈现焦亡的形态(细胞膨胀并形成大的气泡),并且这一过程依赖于Stat3-Y705的磷酸化和PD-L1入核,这表明在肿瘤细胞系中,nPD-L1能够诱导细胞发生焦亡。
4. 接着作者探究nPD-L1诱导细胞发生焦亡的机制。GSDMs家族蛋白是细胞焦亡的主要执行者,因此,作者在肿瘤细胞中检测了各种GSDMs蛋白的表达,结果显示在PD-L1-NES细胞中,只有GSDMC的表达量显著上调,并且这种上调依赖于Stat3-Y705的磷酸化。此外,作者通过数据库预测和染色质免疫沉淀实验发现磷酸化的Stat3-Y705能够结合在GSDMC的启动子区域,从而促进后者的表达。
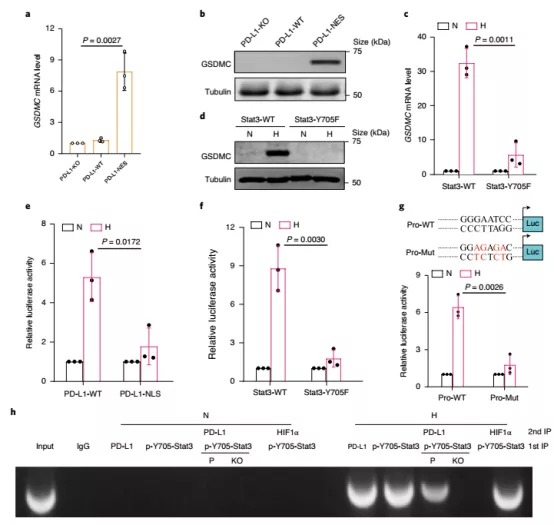
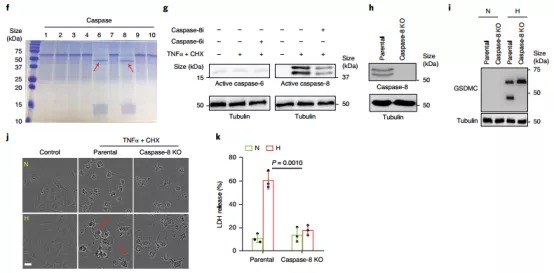
5. PD-L1/ p-Stat3-Y705复合物上调表达的GSDMC是如何活化介导焦亡呢?先前的研究指出GSDMs蛋白家族成员能够被caspase剪切活化,从而行使焦亡功能。作者测试了多种caspase蛋白对GSDMC的剪切作用,结果显示只有caspase-6和caspase-8能剪切GSDMC。但是使用TNFα 和CHX处理细胞时,仅有caspase-8能够活化,并且caspase-8缺陷后,GSDMC的剪切受到明显抑制,细胞焦亡的发生也显著减少,这表明TNFα和CHX能够诱导caspase-8活化,从而剪切GSDMC,诱导细胞焦亡。
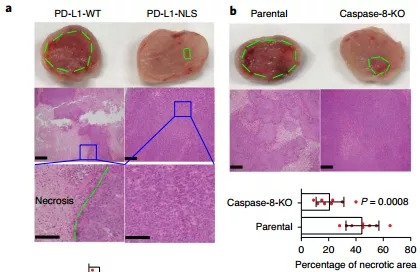
6. 既然在体外低氧能够诱导PD-L1入核诱导细胞焦亡,那在体内是否也有相同的现象呢?通过皮下荷瘤模型,作者发现在WT小鼠的实体瘤区域,由于缺氧环境,细胞大量死亡。但是当PD-L1核定位信号突变或者caspase-8缺陷时,细胞死亡受到明显抑制,这表明在体内PD-L1也能够诱导细胞焦亡。
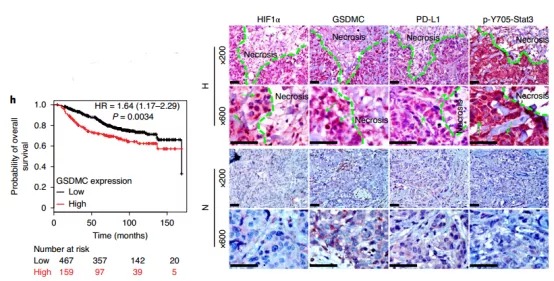
7. 为了进一步确定这个结果,作者对小鼠肿瘤区域的组织进行免疫组化,结果显示在低氧区域,PD-L1与p-Stat3-Y705共定位于细胞核中,并且GSDMC的表达显著上调。此外,通过对乳腺癌病人样本进行分析,作者发现GSDMC高表达的病人呈现出更低的生存率。这表明低氧诱导GSDMC表达和细胞焦亡,从而促进肿瘤发生和抑制抗肿瘤免疫。
总结
总结这篇文章,作者发现低氧条件下,TNFα 和CHX处理能够促进PD-L1进入细胞核中与p-Stat3-Y705相互作用,随后p-Stat3-Y705结合在GSDMC启动子区域,上调后者的表达。接着GSDMC被caspase-8剪切活化进而诱导细胞发生焦亡。该论文不仅发现了PD-L1除免疫检查点外的新功能,还揭示了肿瘤坏死的新机制,为肿瘤治疗提供新的药物靶点。